Nos services
RÉGLEMENTATION
Médicaments à usage humain et/ou vétérinaire
Découvrez ce que Konexio Biotech peut faire pour votre entreprise dans tous les domaines liés aux médicaments à usage humain et/ou vétérinaire.
- Soutien réglementaire et élaboration de stratégies (feuille de route).
- Examen de l'exhaustivité et de l'exactitude des documents réglementaires.
- Préparation et soumission de dossiers réglementaires aux organismes de réglementation.
- Réalisation d'audits réglementaires sur les dossiers d'enregistrement.

Médicaments
- Stratégie à suivre pour obtenir l'approbation plus rapidement (feuilles de route), suivi (audits de dossiers) et gestion de projet.
- Conseil scientifique auprès de l'agence réglementaire.
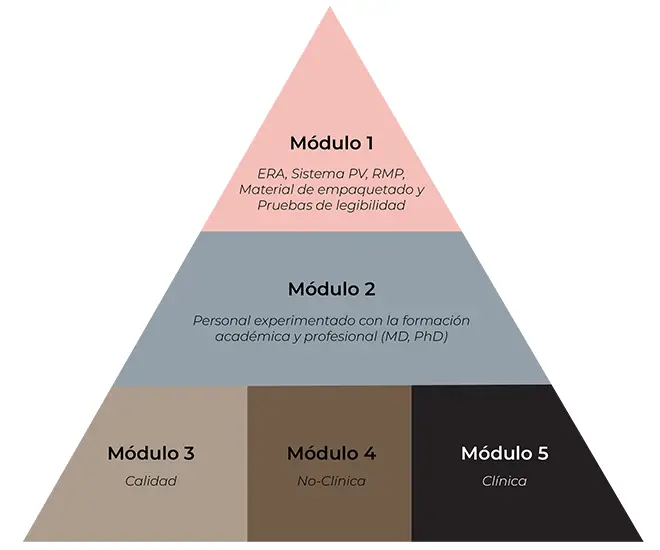
- Révision, évaluation et développement de tous les modules :
Module 1: ERA (European Risk Assessment), système PV (Pharmacovigilance System), PGR (Risk Management Plan), matériaux d’emballage et tests de lisibilité.
Module 2: Personnel expérimenté ayant une formation universitaire et professionnelle (MD, PhD).
Module 3: Qualité
Module 4: Non clinique
Module 5: Clinique
Produits Sanitaires
- Élaboration de plans de gestion des risques liés aux produits.
- Obtention de licences de fabricant, d'importateur, de stérilisateur ou de groupement.
- Qualification et classification réglementaire des dispositifs médicaux.
- Préparation de dossiers techniques pour les produits MDR et IVDR.
- Coordination des produits fabriqués « en interne ».
- Coordination avec les organismes notifiés.
- Obtention du marquage CE


Cosmétiques
- Demande de certificat de produit cosmétique.
- Déclaration responsable des activités de fabrication et/ou d'importation de produits cosmétiques.
- Préparation du dossier d'information et de notification.
- Préparation du rapport de sécurité.
- Notification au portail européen.
Produits nutraceutiques
- Compléments alimentaires.
- Enregistrement de l'entreprise responsable du marché auprès de RGSEAA (Registre Général Sanitaire des Entreprises Alimentaires et des Aliments).
- Communication du premier produit mis sur le marché.
- Modifications et cessation d'activité.
- Enregistrement des nouveaux aliments.
Notre processus de travail
Découvrez le processus de travail que nous suivons chez Konexio Biotech pour façonner votre projet de manière complète.
Étape-01
Analyse réglementaire initiale
Nous évaluons le cadre réglementaire applicable au produit, y compris la région cible et les classifications requises pour la conformité réglementaire.
Étape-02
Développement d'une stratégie réglementaire
Nous élaborons une feuille de route claire et personnalisée pour répondre aux exigences des autorités compétentes, en optimisant le temps et les ressources.
Étape-03
Préparation des dossiers
Nous préparons les dossiers techniques et réglementaires, y compris les modules de qualité, de sécurité et d’efficacité, prêts à être soumis aux autorités réglementaires.
Étape-04
Gestion des interactions réglementaires
Nous agissons en tant qu’intermédiaires avec des agences telles que l’EMA ou la FDA, en traitant les questions, les demandes de clarification et les mises à jour des dossiers.
Étape-05
Soutien post-approbation
Nous suivons et gérons les changements réglementaires, les renouvellements de licence et les mises à jour nécessaires pour maintenir la conformité après l’approbation du produit.
Souhaitez-vous en savoir plus sur les affaires réglementaires?
Nous proposons la classification des dispositifs, la préparation des dossiers techniques, la préparation des audits et l'aide à l'obtention du marquage CE et d'autres approbations mondiales.
Nous assurons une liaison directe avec les agences telles que la FDA, l'EMA et les autorités locales, en facilitant les réunions, les consultations scientifiques et les soumissions réglementaires.
Nous aidons à la préparation et à la soumission des demandes de nouveaux médicaments de recherche (IND) et des demandes d'essais cliniques (CTA), en veillant à la conformité avec les exigences spécifiques à chaque région.
Oui, nous avons de l'expérience dans les enregistrements réglementaires en Amérique, en Amérique latine, en Europe, en Asie et dans d'autres marchés émergents.
Nous surveillons les changements réglementaires et nous aidons à maintenir la conformité grâce à des mises à jour opportunes des dossiers réglementaires et de la documentation sur les produits.
Oui, nous veillons à ce que le matériel d'étiquetage soit conforme aux réglementations nationales et internationales et qu'il soit clair pour les patients et les professionnels de la santé.
Nous avons travaillé sur les thérapies CAR-T, les thérapies géniques et les médicaments orphelins, en fournissant des stratégies réglementaires sur mesure pour ces technologies innovantes.
Nous évaluons les exigences spécifiques des produits combinés et préparons des stratégies réglementaires couvrant à la fois le composant pharmaceutique et le dispositif.
Oui, nous réalisons des audits internes et des audits de fournisseurs afin d'identifier les domaines à améliorer et de garantir la conformité réglementaire.
Oui, nous préparons les entreprises aux inspections et nous les assistons pendant et après le processus pour répondre aux éventuelles constatations.
Lundi - Vendredi: 9:00 - 19:00 h.
Newsletter
© 2024. Tous droits réservés.
Un autre site Web créé par Palabra de Ciervo

