Fabricación descentralizada de medicamentos en Terapias Avanzadas

Clara Caja. Técnico de Regulatory Affairs en Konexio Biotech
Por definición, los medicamentos de Terapia Avanzada (ATMP) se dividen en cuatro grandes categorías según queda recogido en el Reglamento (CE) N.º 1394/2007 y el Real Decreto Legislativo 1/2015, de 24 de julio: medicamentos de terapia génica, medicamentos de terapia celular, productos de ingeniería de tejidos y medicamentos de terapias avanzadas combinados con uno o más productos sanitarios.
Los medicamentos de Terapia Avanzada se encuentran regulados por el Reglamento (CE) Nº 1394/2007. Es fundamental que, como todos los medicamentos, se fabriquen siguiendo las normas de correcta fabricación (NCF o GMP por sus siglas en inglés). El volumen 4 de EudraLex (normas por las que se rigen los medicamentos en la Unión Europea), contiene las pautas para la interpretación de los principios y directrices de buenas prácticas de fabricación de medicamentos para uso humano y veterinario.
El volumen 4 de EudraLex se divide en cuatro partes: Parte I Requisitos básicos para los medicamentos, Parte II Requisitos básicos para las sustancias activas utilizadas como materiales de partida, Parte III Documentos relacionados con GMP y Parte IV Requisitos de GMP para medicamentos de terapia avanzada. Por lo que teniendo en cuenta esto, los medicamentos de Terapia Avanzada se fabricarán siguiendo lo establecido en la Parte IV de las NCF.
Actualmente existen dos rutas generales para la entrega a gran escala de ATMP a los pacientes: fabricación centralizada y descentralizada (Figura 1).
La fabricación centralizada se considera la fabricación tradicional de estos medicamentos, y consiste en una única instalación que lleva a cabo la producción y se encarga de suministrar los ATMP a una gran región geográfica. Para el tratamiento personalizado, esto puede ocurrir en una región discreta o puede requerir el transporte de las células del paciente a largas distancias.
La fabricación descentralizada ha surgido recientemente y consiste en la producción de ATMP en centros regionales («hubs») que están cerca de los centros de tratamiento y entregan los productos a su entorno inmediato.
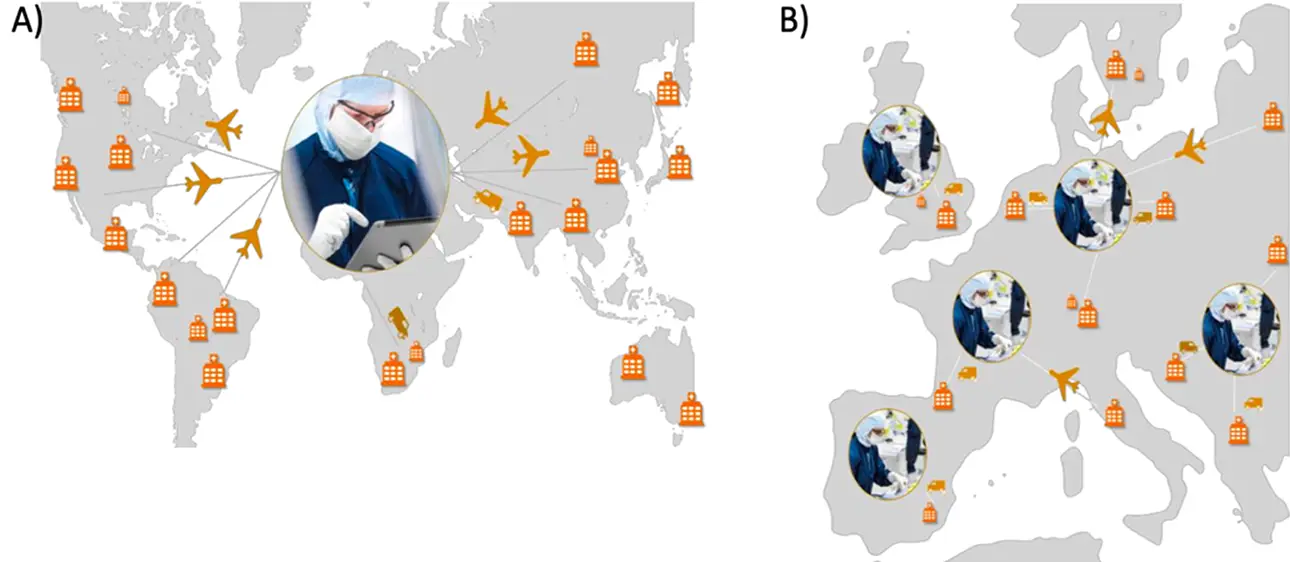
Figura 1. A) Fabricación centralizada de ATMP. B) Fabricación descentralizada de ATMP. Fuente: Roadmap of the needs and strategy of the Implementation of new Advanced Therapies. Restore horizon
La fabricación centralizada puede presentar algunas desventajas y desafíos en comparación con la fabricación descentralizada de ATMP. La fabricación farmacológica convencional es un proceso altamente centralizado e implica una logística complicada de la cadena de suministro y la criopreservación. Si bien este es un proceso probado en el tiempo y económicamente sostenible para los medicamentos farmacológicos tradicionales, puede ser difícil de escalar a medicamentos de terapia avanzada, especialmente a terapias celulares autólogas.
La fabricación de terapia celular centralizada puede llevar mucho tiempo debido a varios factores. En primer lugar, el proceso de aislamiento y expansión de las células puede llevar una cantidad significativa de tiempo. Además, garantizar la accesibilidad de la terapia a los pacientes puede ser un desafío que requiere mucho tiempo, especialmente para aquellos que están lejos de las instalaciones de fabricación centralizadas. La logística involucrada en el transporte de la terapia a estos pacientes puede plantear obstáculos y retrasos significativos.
La descentralización cambia la fabricación de la terapia celular a un proceso más distribuido al acercarla a los pacientes ya que mejora el acceso y la comodidad al paciente, los médicos con acceso a un laboratorio local de terapia celular y génica pueden trabajar con el personal local para crear aprobación previa, programar la recolección, crear tratamiento, liberar el tratamiento y administrar el tratamiento de la manera más rápida posible. Los factores limitantes de la tasa se reducen ya que el material del paciente está disponible localmente para el centro de tratamiento descentralizado, reduciendo por tanto los desafíos logísticos y de transporte.
La fabricación descentralizada es el modelo preferido para productos celulares autólogos. Es aplicable tanto a enfoques farmacéuticos como a empresas biotecnológicas más pequeñas y a hospitales especializados que están produciendo ATMP. Cada centro debe ser capaz de entregar ATMP equivalentes, sin importar la ubicación o los operadores, por ello, han surgido sistemas de gestión integrados y automatizados que permiten que el producto de aféresis pase por las múltiples etapas de la fabricación dentro de un kit desechable de un solo uso que no se abre directamente al entorno. La extracción de muestras y la adición de reactivos o medios se realizan mediante soldadores de tubos estériles o puertos de acceso aséptico, manteniendo así lo que se conoce como un sistema funcionalmente cerrado disminuyendo por tanto la variación causada por los operarios. Los dispositivos automatizados se han convertido en el método preferido para la fabricación descentralizada de CAR T. Algunos de estos dispositivos son CliniMACS Prodigy© o Lonza Cocoon©.
Tal y como se indica en la Parte IV de las NCF la certificación y liberación de lotes de ATMP fabricados bajo un sistema descentralizado es especialmente importante ya que la fabricación en múltiples localizaciones aumenta el riesgo de variabilidad del producto.
En particular, a través del proceso de certificación y liberación del lote deberá asegurarse que cada lote liberado en cualquiera de las localizaciones ha sido fabricado y verificado de acuerdo con los requisitos de autorización de comercialización/ ensayo clínico y con otros requisitos regulatorios pertinentes incluido el cumplimiento de las NCF. Teniendo esto en cuenta, deben considerarse los siguientes aspectos:
Se debe identificar una instalación central, la cual debe estar establecida en la UE. La instalación central es responsable de supervisar las localizaciones descentralizadas. La instalación central debe asumir, como mínimo, las siguientes tareas: asegurar que quienes participen en el proceso de certificación y liberación de lotes estén adecuadamente cualificados y formados para sus tareas, y realizar auditorías para confirmar que se cumple con el proceso de certificación y liberación de lotes tal y como se describe en el procedimiento normalizado de trabajo (PNT).
Se debe establecer un contrato o acuerdo técnico entre la instalación central y las localizaciones descentralizadas. Este acuerdo debe establecer las responsabilidades de cada una de las partes, incluyendo la responsabilidad de la persona cualificada (QP).
La persona cualificada (QP), tiene la responsabilidad última para certificar que un lote de ATMP cumpla con los requisitos de calidad y pueda ser liberado. La QP de la instalación central puede confiar en los datos de las localizaciones descentralizadas siempre que estos hayan sido proporcionados por personal cualificado y formado.
Por todo lo anteriormente expuesto, la fabricación descentralizada de medicamentos de terapia avanzada, en concreto de terapias celulares representa un paso hacia un sistema de atención médica más inclusivo, donde los tratamientos avanzados no son un privilegio, sino un derecho accesible para todos.
Bibliografía
- Reglamento (CE) nº 1394/2007 del parlamento europeo y del consejo, de 13 de noviembre de 2007, sobre medicamentos de terapia avanzada y por el que se modifican la Directiva 2001/83/CE y el Reglamento (CE) Nº 726/2004.
- Parte IV Directrices sobre normas de correcta fabricación específicas para medicamentos de Terapia Avanzada.
- D 4.1 Roadmap of WP4. Roadmap of the needs and strategy of the implementation of new Advanced Therapies de Restore Horizon
- Shah, M., Krull, A., Odonnell, L., de Lima, M. J., & Bezerra, E. (2023). Promises and challenges of a decentralized CAR T-cell manufacturing model. Frontiers in transplantation, 2, 1238535.
- Decentralized manufacturing of cell and gene therapies: Overcoming challenges and identifying opportunities Harrison, Richard P. et al. Cytotherapy, Volume 19, Issue 10, 1140 – 1151
- Beyond Urban Centers: Expanding CAR-T Therapy with Decentralized Manufacturing. Boston Labs – Inspired Clinical Logistics.
