GRATA RERUM NOVITAS CAR-T: las dos caras de nuestro sistema inmunológico
Las células CAR-T son un tipo de tratamiento en el que las células T de un paciente (un tipo de célula inmunitaria) se modifican en el laboratorio para que se unan a las células cancerosas y las destruyan. La sangre de una vena del brazo del paciente fluye a través de un tubo hasta una máquina de aféresis, que extrae los glóbulos blancos, incluidas las células T, y envía el resto de la sangre de regreso al paciente. Luego, el gen de un receptor especial llamado receptor de antígeno quimérico (CAR) se inserta en las células T en el laboratorio. Millones de células CAR-T se cultivan en el laboratorio y luego se administran al paciente mediante infusión. Las células CAR T pueden unirse a un antígeno de las células cancerosas y matarlas (Figura 1).

Figura 1. Esquema representativo de la generación de CAR-T cells.
La terapia con células T con receptor de antígeno quimérico (CAR-T) ha sido revolucionaria ya que ha producido respuestas clínicas notablemente efectivas y duraderas. Los CAR son receptores sintéticos diseñados que funcionan para redirigir los linfocitos o células T, para reconocer y eliminar células que expresan un antígeno objetivo específico. La unión de CAR a los antígenos diana expresados en la superficie celular es independiente del receptor MHC, lo que da como resultado una activación vigorosa de las células T y potentes respuestas antitumorales.
El éxito sin precedentes de la terapia con células CAR-T anti-CD19 contra las neoplasias malignas de células B ha dado lugar a la aprobación de un total de 6 medicamentos por parte de la Agencia Europea del medicamento (EMA, por sus siglas en inglés)
(Tabla 1).
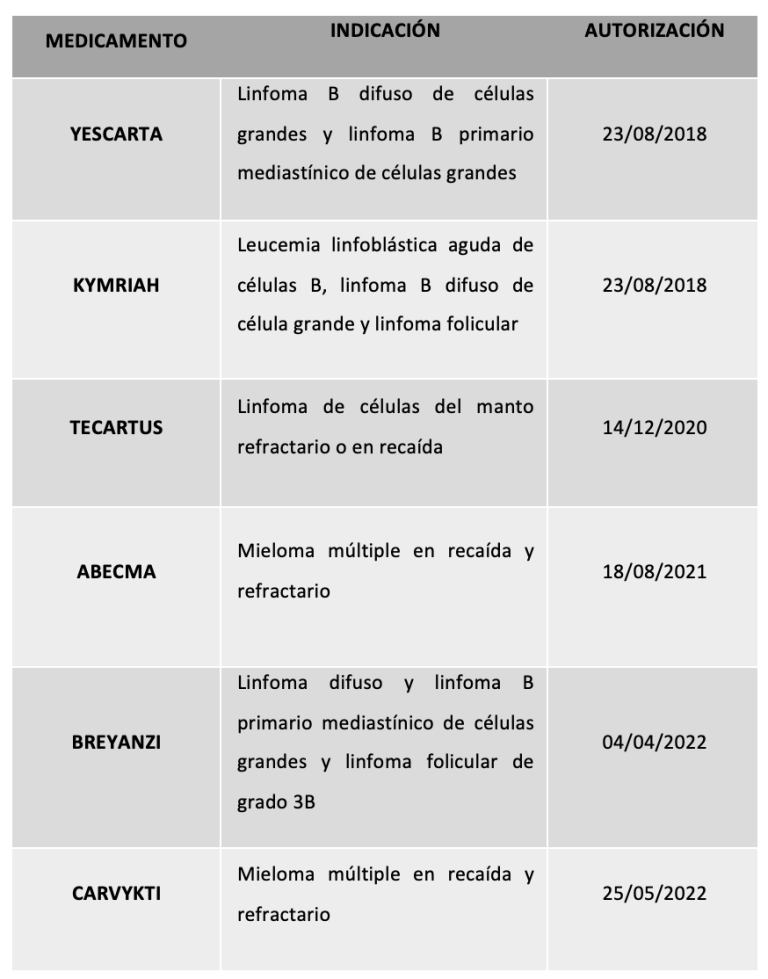
Tabla 1. Terapias CAR-T aprobadas por la EMA actualmente.
Sin embargo, existen limitaciones importantes para la terapia con células CAR-T que aún deben abordarse, incluidas las toxicidades asociadas a las células CAR-T que ponen en peligro la vida, la eficacia limitada contra tumores sólidos, la inhibición y la resistencia en las neoplasias malignas de células B, el escape de antígenos, la persistencia limitada, la mala tráfico e infiltración tumoral, y el microambiente inmunosupresor. Además, la fuerza laboral debe adaptarse para satisfacer las necesidades de este campo en crecimiento y evolución mediante el desarrollo de programas educativos para capacitar a la fuerza laboral.
Se han propuesto muchos enfoques, incluida la combinación de la terapia con células CAR-T con otras terapias contra el cáncer o el empleo de estrategias innovadoras de ingeniería CAR para mejorar la eficacia antitumoral, ampliar la eficacia clínica y limitar las toxicidades. En lo que se refiere a sus efectos secundarios potenciales, los más comunes son diarrea, vómito, cefalea, mareos y debilidad. Más graves son la neurotoxicidad o la ampliamente conocida tormenta de citoquinas, ambas fruto, del funcionamiento de este tipo de terapia génica que desencadena un proceso inflamatorio sistémico en cascada.
En este sentido, no se debe olvidar que, a finales del pasado año 2023, la Agencia Nortemericana, FDA, lanzó un aviso de “riesgo grave” tras recibir 19 informes de malignidad de células T en pacientes tratados. Esto afectaría a las 6 terapias basadas en CAR-T aprobadas hasta la fecha (Tabla 1), pero los especialistas advierten que se trata de un procedimiento de seguridad habitual y los beneficios superan con creces los posibles problemas. No obstante, a nivel nacional, contamos con investigadores y equipos de profesionales que ya buscan ir un paso más allá de la técnica. Su objetivo: potenciar la versatilidad y ventajas de las células CAR-T, minimizando al mismo tiempo sus limitaciones.
Un ejemplo de ello es el ambicioso proyecto con investigadores del Centro Superior de Investigaciones Científicas (CSIC) que desarrollará cápsulas biológicas que albergarán células CAR-T (células inmunitarias diseñadas específicamente para atacar moléculas expresadas en determinados subtipos de tumores) con las que tratar de forma más efectiva y específica tumores sólidos. Como un caballo de Troya microscópico, estas cápsulas o píldoras diminutas ocultarán en su interior células antitumorales y podrán así invadir la zona cancerosa y acabar con las células malignas desde dentro del tumor. En el proyecto, financiado por el Ministerio de Ciencia e Innovación, participan el Centro de Investigación del Cáncer de Salamanca (CIC, un instituto mixto de investigación del CSIC y la Universidad de Salamanca), el Centro de Investigación Biomédica en Red de Cáncer (CIBERONC), la Universidad de Santiago de Compostela (USC) y el Centro de Investigación de Medicina Aplicada (CIMA) de la Universidad de Navarra.
Otro claro ejemplo es el de los investigadores del Grupo de Hematología Experimental del Vall d’Hebron Instituto de Oncología (VHIO), que forma parte del Campus Vall d’Hebron. Estos han participado en el desarrollo de una nueva tecnología para procesar células CAR-T de manera más rápida y eficaz que podría disminuir el tiempo de espera de los pacientes al recibir el tratamiento. Los resultados del estudio en modelos preclínicos y los resultados preliminares del primer ensayo clínico en pacientes con linfoma no Hodking B han sido publicados en la revista Cancer Discovery.
Esto demuestra el posicionamiento de España como una de las piezas clave en la puesta a punto y optimización de una de las terapias más revolucionarias a nivel tecnológico de los últimos años.
En lo que se refiere a su regulación y normativa aplicable, las CAR-T son un tipo de medicamento humano biológico y más concretamente un tipo de Terapia Avanzada, por lo que les aplicaría la parte IV de las normas de Correcta Fabricación (GMP, de sus siglas en inglés). Asimismo, tal y como se recoge en la guía EMA/CAT/600280/2010 Rev.1:
‘Gene therapy medicinal product means a biological medicinal product which fulfils the following two characteristics:
(a) it contains an active substance which contains or consists of a recombinant nucleic acid used in or administered to human beings with a view to regulating, repairing, replacing, adding or deleting a genetic sequence.
(b) its therapeutic, prophylactic or diagnostic effect relates directly to the recombinant nucleic acid sequence it contains, or to the product of genetic expression of this sequence.
Gene therapy medicinal products shall not include vaccines against infectious diseases.’
Siendo las CAR-T cells, células T modificadas genéticamente y por lo tanto considerándose un producto de terapia génica.
Bibliografía:
- De Marco R. C., Monzo H. J., Ojala P. M. CAR T Cell Therapy: A Versatile Living Drug.IJMS, 2023; 24(7), 6300. https://doi.org/10.3390/ijms24076300.
- Labanieh L., Majzner R.G., Mackall C.L. Programming CAR-T Cells to Kill Cancer. Biomed. Eng. 2018;2:377–391. doi: 10.1038/s41551-018-0235-9.
- Sterner R.C., Sterner R.M. CAR-T Cell Therapy: Current Limitations and Potential Strategies. Blood Cancer J. 2021;11:69. doi: 10.1038/s41408-021-00459-7.
- Wagner D.L., Fritsche E., Pulsipher M.A., Ahmed N., Hamieh M., Hegde M., Ruella M., Savoldo B., Shah N.N., Turtle C.J., et al. Immunogenicity of CAR T Cells in Cancer Therapy. Rev. Clin. Oncol. 2021;18:379–393. doi: 10.1038/s41571-021-00476-2.
- Park J.H., Rivière I., Gonen M., Wang X., Sénéchal B, Curran K.J., et al. Long-Term Follow-up of CD19 CAR Therapy in Acute Lymphoblastic Leukemia. N Engl J Med. 2018;378:449–59. doi: 1056/NEJMoa1709919.
